Pesquisadores da USP identificaram genes de resistência ao Trypanosoma cruzi no DNA de diferentes populações indígenas da floresta, favorecidos pela seleção natural.
Milhares de anos atrás, muito antes dos primeiros europeus colocarem os pés na América do Sul e de Carlos Chagas descrever a doença que hoje leva o seu nome, os povos nativos da Amazônia já conviviam com um inimigo “invisível”, microscópico, que somente no início do século 20 o sanitarista brasileiro viria a identificar como o Trypanosoma cruzi — o parasita causador da tripanossomíase americana, ou doença de Chagas.
Não foi uma convivência muito agradável, pelo que contam os genes dos descendentes dessas populações. Segundo um estudo liderado por pesquisadores da USP e publicado na última edição da revista Science Advances, a pressão exercida pelo parasita sobre as populações indígenas da Amazônia no passado foi tão grande que resultou num processo de seleção natural, favorável àqueles que tinham alguma resistência genética à doença, e potencialmente letal para aqueles que não a tinham.
Em outras palavras, a exposição ao Trypanosoma cruzi criou uma espécie de funil evolutivo, pelo qual indivíduos naturalmente mais resistentes a ele tiveram mais chances de seguir adiante e deixar descendentes do que os não resistentes. Nesse sentido, pode-se dizer que a doença de Chagas moldou de certa forma o genoma dos povos originários da Amazônia, decidindo quem tinha mais chances de morrer ou de sobreviver naquele momento.
Como é possível saber que isso aconteceu? Os pesquisadores investigaram o DNA de 118 indivíduos de 19 povos originários da Amazônia (como guarani, karitiana, surui e xavante) e identificaram um punhado de mutações em genes relacionados à doença de Chagas que aparecem com mais frequência nessas populações do que em outras, analisadas a partir de bancos de dados genômicos. Por exemplo, genes relacionados a características cardiovasculares, metabólicas e de reação imunológica a picadas de mosquito ou ao próprio Trypanosoma cruzi — um parasita unicelular (protozoário), transmitido pelas fezes de insetos triatomíneos, popularmente conhecidos como barbeiros.
O que chamou mais atenção foi o PPP3CA, um dos genes envolvidos na resposta do sistema imunológico ao parasita, que dava fortes sinais de ter sido alvo de seleção — com uma mesma mutação presente no DNA de mais de 80% dos indivíduos nativos investigados. Com base nessas evidências genômicas, os pesquisadores montaram um experimento com células em cultura para testar, na prática, se uma alteração nesse gene poderia conferir maior ou menor proteção contra a doença de Chagas.
E foi exatamente o que aconteceu: usando técnicas de engenharia genética, eles produziram células cardíacas humanas com uma versão alterada desse gene e verificaram que elas tinham 25% menos parasitas dentro delas do que as células não alteradas, “indicando que o PPP3CA desempenha um papel ativo na infecção intracelular pelo parasita e no desfecho da doença”.
Os experimentos celulares foram conduzidos na Universidade Harvard, nos Estados Unidos, por pesquisadores brasileiros ligados ao Instituto do Coração (Incor), da Faculdade de Medicina da USP.
“É a primeira evidência de seleção natural induzida por patógenos em seres humanos na América”,
diz a geneticista Tábita Hünemeier, professora associada do Departamento de Genética e Biologia Evolutiva do Instituto de Biociências (IB) da USP e pesquisadora do Instituto de Biologia Evolutiva (IBE) de Barcelona, na Espanha, que liderou o estudo.
Os resultados podem ajudar a explicar porque a prevalência da doença de Chagas é tão baixa entre populações indígenas da Amazônia, apesar de elas conviverem diretamente com o parasita e seus vetores na natureza. Várias explicações já foram propostas para justificar isso — por exemplo, o fato de indígenas não construírem casas de pau a pique (taipa), que são favoráveis ao vetor —, mas é a primeira vez que se levanta uma explicação genética. “Provavelmente não é o único, mas certamente é um dos fatores de proteção”, avalia Tábita Hünemeier.
Com base nas evidências genômicas, os pesquisadores calculam que esse “funil” evolutivo criado pelo Trypanosoma cruzi tenha se formado 7.500 anos atrás, depois que os ramos evolutivos das populações indígenas da Amazônia, dos Andes e da costa oeste da América se separaram — o que reforça a hipótese de que essa seleção seja exclusiva dos povos da floresta tropical, que precisaram se adaptar a uma série de adversidades para sobreviver ali.
“Apesar de ser rico em nutrientes, [a Amazônia] também é um ambiente hostil, apresentando diversos obstáculos à sobrevivência humana em longo prazo. Vários desafios, incluindo a instabilidade dos recursos alimentares, baixa penetração de luz e alta diversidade de patógenos provavelmente contribuem para fortes pressões seletivas para a sobrevivência e a reprodução humana”, escrevem os pesquisadores.
A datação genômica está em sincronia com evidências arqueológicas, extraídas de múmias sul-americanas, que mostram que o Trypanosoma cruzi já infectava seres humanos há pelo menos sete mil anos no Brasil e nove mil anos, em outras partes do continente (Chile e Peru).
O estudo também se encaixa bem com a narrativa arqueológica de povoamento da Amazônia, segundo o pesquisador Eduardo Neves, professor e diretor do Museu de Arqueologia e Etnologia (MAE) da USP, especialista no assunto. As evidências mais antigas de ocupação humana na Amazônia, segundo ele, têm aproximadamente 12 mil anos de idade.
A partir de 7 mil anos atrás há evidências claras de alteração da paisagem e domesticação de plantas em vários pontos da região. “O estudo tende a reforçar a ideia de que havia grandes aglomerados populacionais já estabelecidos na Amazônia naquele momento”, avalia Neves, lembrando que seria necessária uma concentração demográfica minimamente relevante para que a pressão seletiva exercida pelo Trypanosoma cruzi pudesse atuar sobre o genoma humano dessa forma.
Pesquisadores estimam que algo entre 8 e 10 milhões de pessoas já viviam na Amazônia quando os primeiros europeus começaram a perambular pela América, no fim do século 15, trazendo um monte de novas doenças com eles. A partir daí, a população nativa despencou.
Atualmente, estima-se que haja cerca de 1 milhão de indígenas vivendo na Amazônia, e todos eles estão expostos à doença de Chagas de alguma forma. Tanto o parasita quanto os seus vetores estão amplamente distribuídos pela região, infectando quase todas as espécies de mamíferos da floresta, segundo o parasitologista Bruno Fermino, pós-doutorando no Instituto de Ciências Biomédicas (ICB) da USP e especialista em tripanossomatídeos. “A população que vive na Amazônia está, sim, em contato com o barbeiro e com o Trypanosoma cruzi“, reforça ele.
As habitações de palha utilizadas por vários povos da floresta também são “ótimos dormitórios” para os barbeiros, segundo Fermino, tal qual as casas de pau a pique. O inseto fica escondido nas frestas das paredes durante o dia e sai à noite para se alimentar do sangue de pessoas ou outros animais que estejam por perto; “então é muito improvável que os indígenas não sejam picados ou não tenham contato com o tripanossoma“, completa.
Além do fator genético identificado no estudo, ele avalia que o fato de as populações indígenas não terem tantos problemas com a doença de Chagas pode estar relacionado a questões culturais e estruturais, como o uso de energia elétrica, já que os barbeiros são atraídos pela luz.
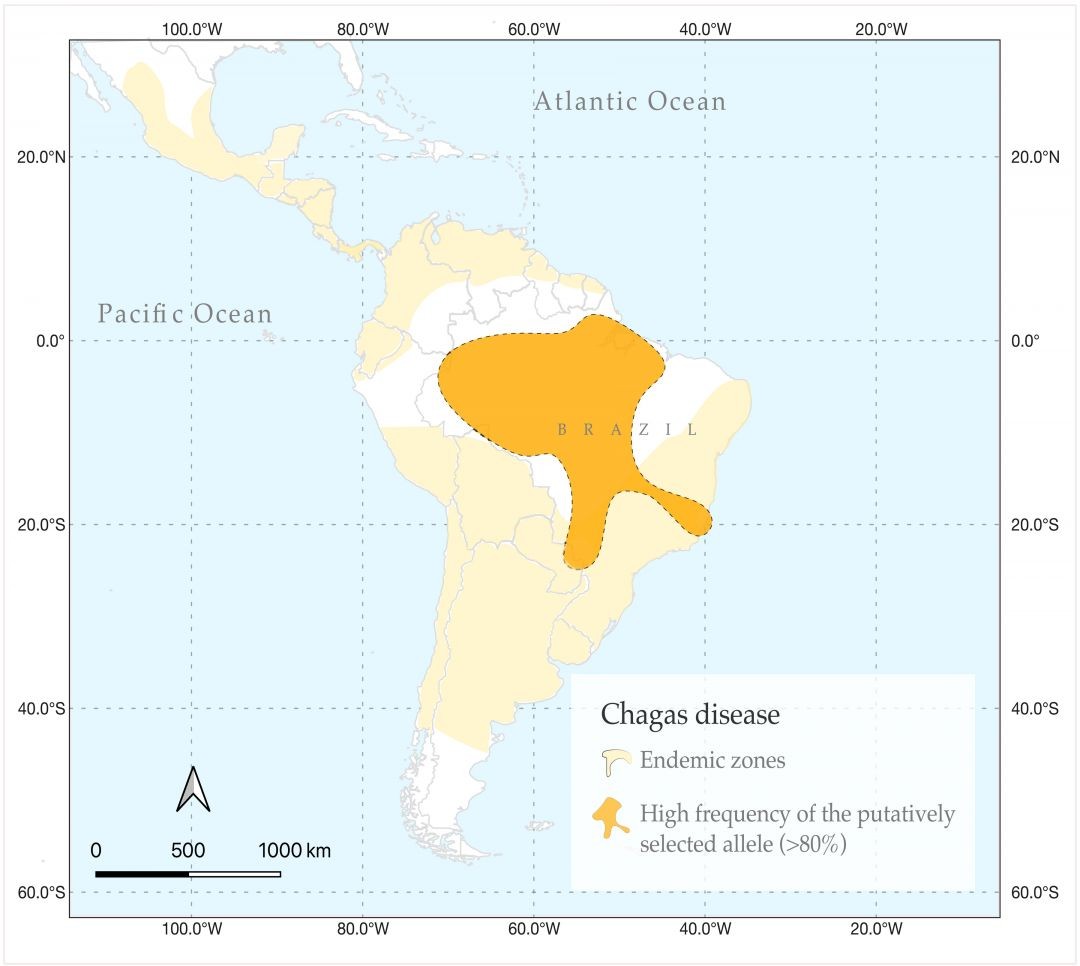
Quando se plota a distribuição das populações indígenas que carregam essa “versão protetora” do gene PPP3CA sobre o mapa do Brasil há uma sobreposição quase que total com as regiões de baixa prevalência da doença de Chagas na América do Sul. O que não significa que o risco do Trypanosoma cruzi deva ser ignorado: a mutação identificada pelos pesquisadores aparentemente reduz o risco de infecção, progressão e transmissão da doença, mas não torna as pessoas imunes.
A doença de Chagas é incurável e cerca de 30% das pessoas infectadas pelo parasita desenvolvem cardiopatias ou outras complicações potencialmente graves, que podem levar à morte. Estudos indicam que a doença afeta entre 6 e 8 milhões de pessoas na América Latina, causando 14 mil mortes por ano. Outras 450 mil pessoas estão infectadas pelo Trypanosoma cruzi na Europa e nos Estados Unidos.
Outras formas de infecção, além da transmissão zoonótica pelo barbeiro, incluem transfusões de sangue, transmissão gestacional (de mãe para filho), e o consumo de sucos ou alimentos contaminados pelo inseto ou por suas fezes.
Todo esse conhecimento moderno só existe graças ao trabalho de Carlos Chagas, o cientista e médico brasileiro que desvendou todo o enredo da tripanossomíase americana no início do século 20, incluindo o parasita, seus vetores, seus hospedeiros, a epidemiologia e as manifestações clínicas da doença.
O trabalho de Chagas foi essencial para controlar as infestações de barbeiro e reduzir o impacto do Trypanosoma cruzi em toda a América Latina. Apesar disso, a doença de Chagas ainda é considerada uma doença tropical negligenciada, carente de novas pesquisas e intervenções clínicas mais eficazes.
A descoberta de um fator genético de proteção pode abrir portas para um melhor entendimento da biologia da doença e, quem sabe, apontar caminhos para o desenvolvimento de novas terapias, baseadas nas proteínas codificadas por esses genes. “Esse é um trabalho que ilustra muito bem o poder desses estudos genômicos para identificar alvos terapêuticos”, diz a professora Lygia da Veiga Pereira, do IB, que também assina o trabalho na Science Advances. “Entre achar um alvo e isso virar um medicamento há um longo caminho a ser percorrido, que na maioria das vezes não chega ao destino desejado; mas é assim que essas caminhadas começam”, finaliza.